Dispositifs médicaux

Ils nous font confiance


Challenge
Les fabricants de dispositifs médicaux doivent gérer une réglementation stricte (ISO 13 485, FDA 21 CFR Part 820, MDR, IDVR) qui impose une traçabilité rigoureuse des données produits et des processus qualité. L’accélération de l’innovation et la complexité croissante des configurations produit nécessitent une collaboration fluide entre R&D, qualité et production pour garantir la conformité dès la conception et éviter les erreurs.
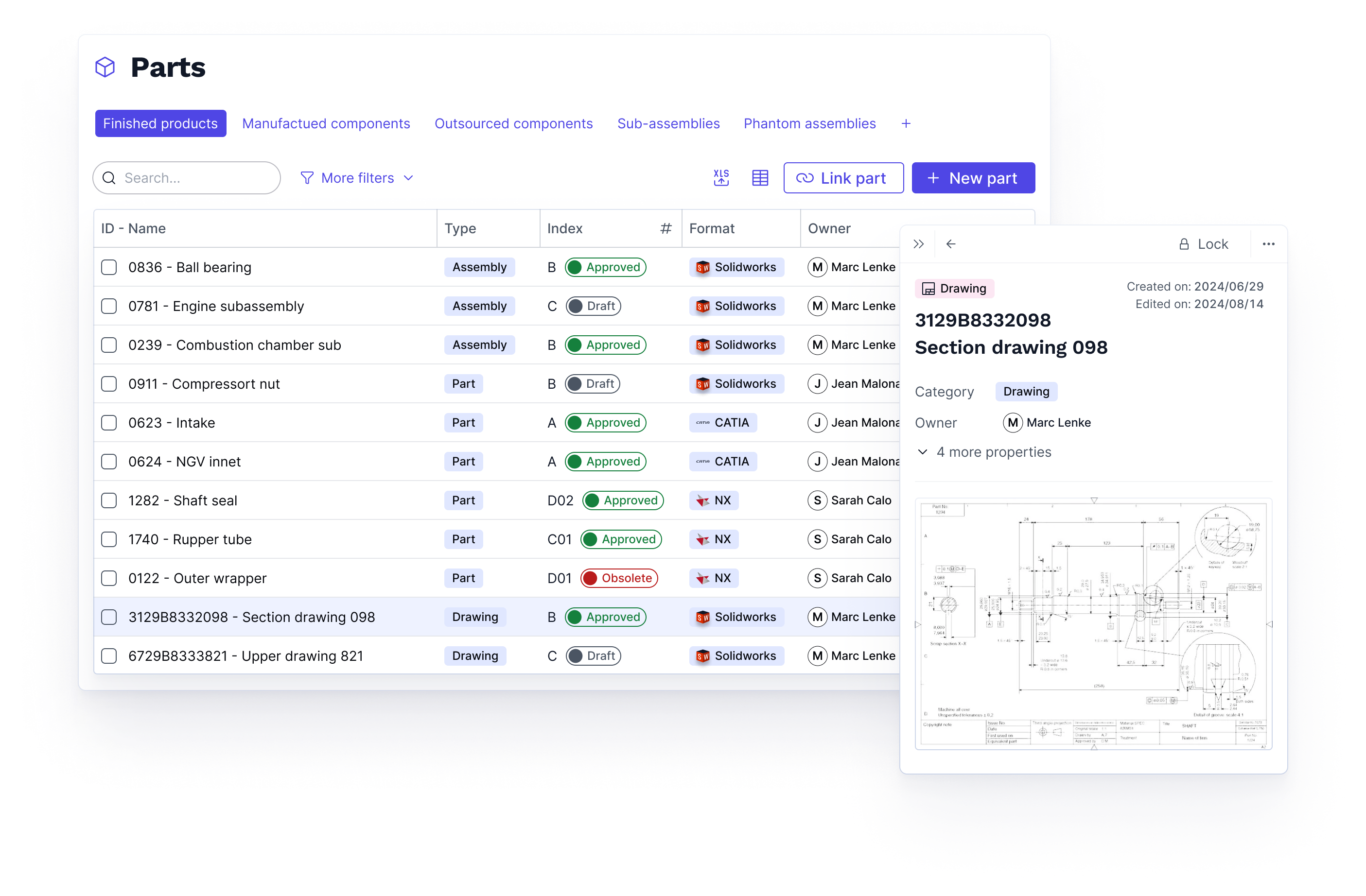
Le PLM Nouvelle Génération Aletiq permet de centraliser les données techniques et réglementaires (DT, DHF, DMR, DHR) dans une source unique de vérité pour garantir la conformité et accélérer l’innovation.

La source unique de vérité pour vos données et processus




100%
conformité à l’ISO 13485, à FDA Part 11, MDR, IDVR
-90%
du temps consacré à la recherche de données
-30%
Time-to-Market
